Instytucja nadzorująca:
Ministerstwo Nauki i Szkolnictwa Wyższego
Kierownik projektu:
dr Anna Baranowska-Korczyc
Budżet:
298 800 PLN
Data rozpoczęcia:
24.02.2015
Czas trwania:
24 miesiące
Numer umowy:
0018/IP2/2015/73
Celem projektu było otrzymanie nanowarstw ZnO/ZnS, ich szczegółowa charakterystyka fizyko-chemiczna, a następnie skonstruowanie modelowych biosensorów na uzyskanych nanostrukturach. Do badań zostały wybrane półprzewodnikowe nanowarstwy polikrystaliczne, gdyż ich geometria, rozmiar oraz stosunek powierzchni do objętości czynią je użytecznym materiałem do produkcji sensorów i biosensorów.
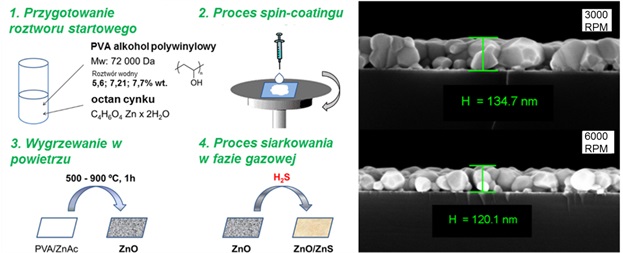
Pierwszym etapem realizacji projektu była synteza nanowarstw ZnO na drodze zol-żel z wykorzystaniem techniki rozwirowywania (spin-coating) oraz wygrzewania w powietrzu. Nanostruktury ZnO uzyskano z polimeru o wysokiej masie cząsteczkowej umożliwiającego tworzenie warstw i octanu cynku jako prekursora do wzrostu krystalitów ZnO. Większe stężenie polimeru w roztworze startowym oraz niższa zastosowana prędkość wirowania powodowały powstanie grubszych warstw ZnO. Podobnie, wyższa temperatura wygrzewania powodowała wzrost większych krystalitów ZnO. Temperatura 700 °C została wyselekcjonowana jako odpowiednia do tworzenia ciągłych i jednorodnych warstw ZnO, o krystalitach ze średnicą około 80 nm. W temperaturze 500 °C obserwowano wertykalny wzrost krystalitów o średnicach około 37 nm, podczas gdy w temperaturze 900 °C powstawały krystality o średnicy około 90 nm, jednocześnie wpływając na powstawanie nieciągłości w warstwie. Powierzchnia ZnO pasywowana była warstwą ZnS w jednoetapowym procesie prowadzonym w fazie gazowej, w obecności par siarkowodoru w temperaturze pokojowej. Nanowarstwy ZnO wykazywały strukturę krystaliczną wurcytu, pokrycie ZnS nie przekraczało 10 nm, a same krystality ZnS o średnicach około 3 nm wykazywały strukturę sfalerytu. Właściwości optyczne nanowarstw ZnO związane były z ich grubością, a po procesie pasywacji ZnS intensywność emisji pasma związanego z przerwą energetyczną ZnO wzrosła o jeden rząd wielkości. Ponadto, po procesie pasywacji ZnS obserwowano poprawę właściwości mechanicznych, elektrycznych, antybakteryjność oraz stabilność w płynach biologicznych nanowarstw ZnO. Moduł Younga i twardość warstw ZnO wzrosły odpowiednio o 14% i 64% po pokryciu cienką warstwą ZnS. Podatność na zniszczenia obu warstw badano z wykorzystaniem metod nanoindentacji stosując różne siły nacisku ostrza przesuwającego się po próbce (nanowear tests). Mniejszą ilość przemieszczonego i zniszczonego materiału odnotowano dla nanowarstw pokrytych ZnS. Ponadto, przewodnictwo elektryczne nanowarstw ZnO wzrosło o około 500 razy po utworzeniu warstwy ZnS jako rezultat pasywacji defektów powierzchniowych oraz poprzez uniemożliwienie cząsteczkom O2 reagowania ze swobodnymi nośnikami. Mapy sygnałów elektrycznych C-AFM wykazały brak defektów powierzchniowych. Dodatkowo, warstwa ZnS nie zmieniła znacząco dużej powierzchni do objętości warstw ZnO, ponieważ tworzona była w fazie gazowej i naśladowała morfologię powierzchni dolnej warstwy ZnO. Warstwa ZnS poprawiła stabilność ZnO w roztworach biologicznych, nanowarstwy ZnO/ZnS po 7 dniach w wodzie pozostały niezmienione, a warstwy ZnO uległy rozpuszczeniu. Właściwości antybakteryjne nanowarstw ZnO względem bakterii Escherichia coli również nieznaczenie wzrosły po pokryciu jej ZnS. Pasywacja powierzchni ZnO jest konieczna do projektowania przyszłych urządzeń detekcyjnych w celu nadania im stabilności w różnych środowiskach, a przy zastosowaniu warstwy ZnS można dodatkowo uzyskać poprawę właściwości mechanicznych, optycznych, elektrycznych i antybakteryjnych.
Na otrzymanych nanowarstwach ZnO/ZnS skonstruowano urządzania tranzystorowe EGFET, (Extended-Gate Field Effect Transistor), w których warstwy stanowiły z rozszerzoną bramkę komercyjnego tranzystora MOSFET (Metal-Oxide Semiconductor Field-Effect Transistor) i były czułe na obecność białek w badanym roztworze. Ponadto, po procesie biofunkcjonalizacji warstw ZnO/ZnS oligonukleotydami DNA wykrywały one selektywnie obecność komplementarnej nici DNA poprzez zmiany przewodnictwa elektrycznego utworzonego układu.


